Obecność różnych modyfikacji w tRNA ma duży wpływ na biosyntezę białek. Tzw. chwiejna urydyna (ang. Wobble uridine) antykodonu jest modyfikowana przez duży kompleks białkowy o nazwie Elongator. Mutacje genomowe w Elongatorze wywołują poważne choroby u ludzi. Najnowsza praca naukowców z Małopolskiego Centrum Biotechnologii (MCB) Uniwersytetu Jagiellońskiego opisuje mechanizm działania oraz pierwsze wysokorozdzielcze struktury ludzkiego Elongatora uzyskane z zastosowaniem krio-mikroskopii elektronowej (krio-EM).
Badanie zostało właśnie opublikowane w Nature Communications.
Naukowcy z Grupy Badawczej Maxa Plancka z MCB Uniwersytetu Jagiellońskiego w Krakowie zrealizowali swój wieloletni cel, jakim było zrozumienie mechanizmu działania ludzki Elongatora. Badania zespołu dr hab. Sebastiana Glatta zostały przeprowadzone we współpracy z naukowcami z Uniwersytetu w Kassel i Uniwersytetu Technicznego w Berlinie. Elongator jest kompleksem białkowym składającym się z dwóch odrębnych podkompleksów, mianowicie Elp123 i Elp456. Grupa karboksymetylowa (cm5) wprowadzona przez Elongator służy jako podstawa do syntezy kolejnych powiązanych modyfikacji. Cząsteczki tRNA ze zmodyfikowaną chwiejną urydyną wiążą się optymalnie z rybosomami zapewniając poprawne fałdowanie nowopowstających białek. Eksperymenty z zakresu biologii strukturalnej i in vitro przeprowadzono w MCB przy wsparciu ośrodków biologii strukturalnej oraz proteomiki i spektrometrii mas w MCB. Dane krio-EM zostały zebrane na wysokiej klasy krio-mikroskopie elektronowym Titan Krios G3i, znajdującym się w Narodowym Centrum Promieniowania Synchrotronowego SOLARIS. Zespół z Kassel przeprowadził analizy in vivo, podczas gdy zespół z Berlina przeprowadził eksperymenty spektrometrii masowej z sieciowaniem.
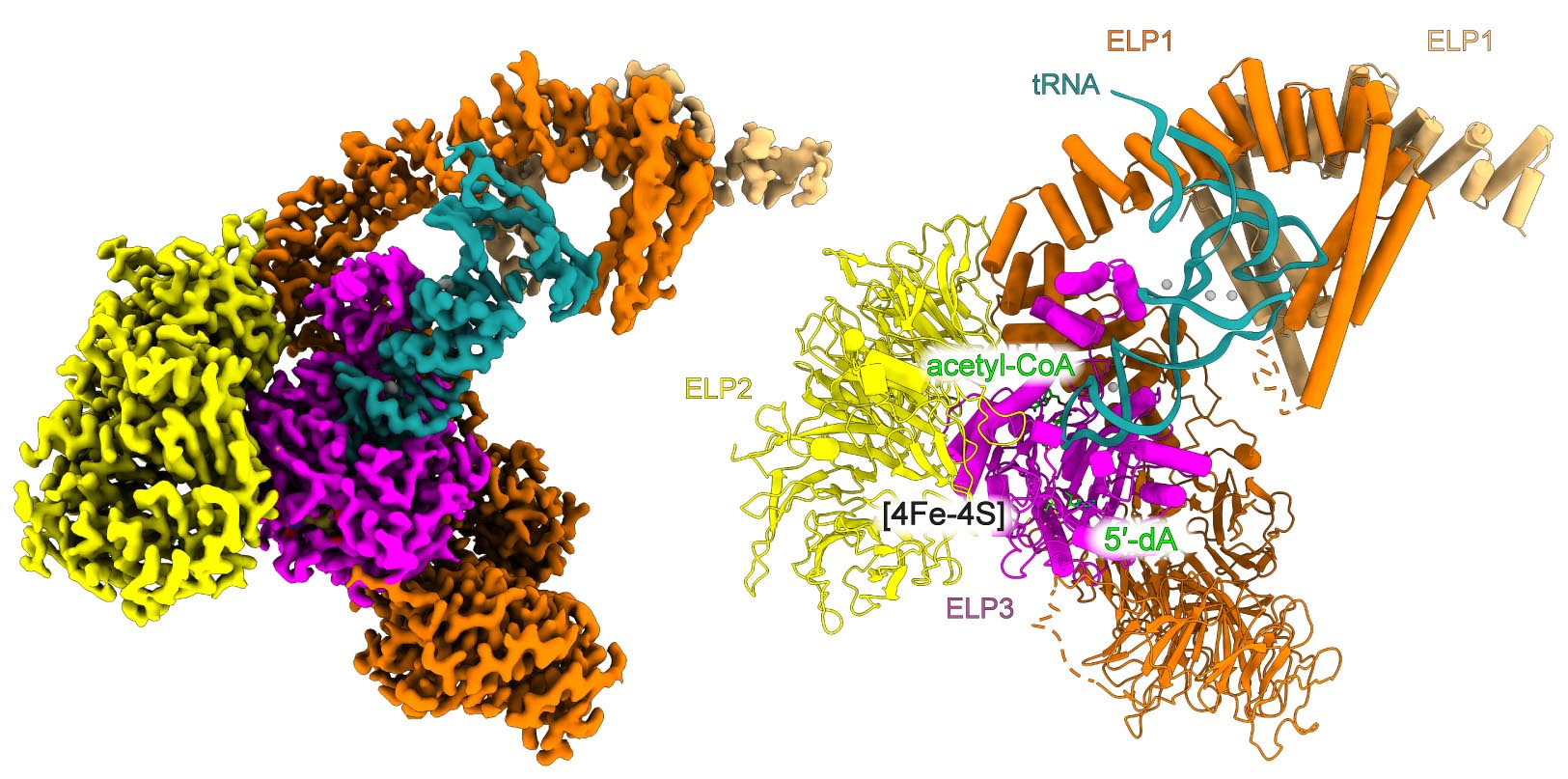
Zespołowi MCB udało się określić strukturę ludzkiego Elongatora o najwyższej dotąd opublikowanej rozdzielczości (2,9 Å). Struktura przedstawia ludzki ELP123 w kompleksie z tRNA i cząsteczką acetylo-CoA oraz organizację miejsca aktywnego wraz z pętlą antykodonu tRNA, która zawiera cel modyfikacji, mianowicie chwiejną urydynę. Struktura ta pozwoliła zidentyfikować nieprzewidzianą rolę innej powszechnie zachowanej dla aktywności ELP123 urydyny, która znajduje się obok chwiejnej urydyny. Praca przedstawia także dodatkowe struktury obrazujące kompleks podczas różnych pośrednich etapów reakcji modyfikacji. Autorzy zidentyfikowali również szereg zachowanych reszt aminokwasowych zlokalizowanych w miejscu aktywnym podjednostki katalitycznej, które są niezbędne do przeprowadzenia reakcji chemicznej. Wszystkie odkrycia zostały zweryfikowane i poparte eksperymentami in vivo i in vitro. „To ekscytujące, że pomimo wcześniejszych intensywnych badaniach Elongatora, pojawienie się nowych technik pomaga nam rzucić wyzwanie naszej wiedzy na temat kompleksu i jego aktywności enzymatycznej.” komentują dwaj pierwsi współautorzy badania, dr Nour-el-hana Abbassi i dr Marcin Jaciuk. Dr hab. Sebastian Glatt, ostatni i korespondencyjny autor, stwierdza, że „naszym celem zawsze było zrozumienie, jak ten klinicznie ważny kompleks białkowy działa u ludzi. Nasza wysoko-rozdzielcza struktura ludzkiego Elp123 pozwala precyzyjnie i bezpośrednio wskazać położenie mutacji, które prowadzą do zaburzeń zdrowotnych związanych z Elongatorem i spróbować zrozumieć ich wpływ na aktywność kompleksu”.
Badania przeprowadzono z funduszy European Research Council pod egidą European Union’s Horizon 2020 and innovation programme (101001394) i Fundacja na rzecz Nauki Polskiej (TEAM TECH CORE FACILITY/2017-4/6).

Mapa gęstości krio-EM (po lewej) i model atomowy (po prawej) subkompleksu ELP123 związanego z tRNA i acetylo-CoA w rozdzielczości 2,87 Å