
Głównym zainteresowaniem naszej grupy są molekularne (pato)mechanizmy prowadzące do dysfunkcji komórek śródbłonka w różnych jednostkach chorobowych u ludzi.
Komórki śródbłonka, wyścielające wewnętrzną ścianę naczyń krwionośnych, obecne są we wszystkich tkankach i narządach, a ich prawidłowe funkcjonowanie niezbędne jest do utrzymania homeostazy organizmu. Poprzez analizę ścieżek molekularnych zaangażowanych w patofizjologię tych komórek, można by w przyszłości wyselekcjonować nowe cele terapeutyczne.
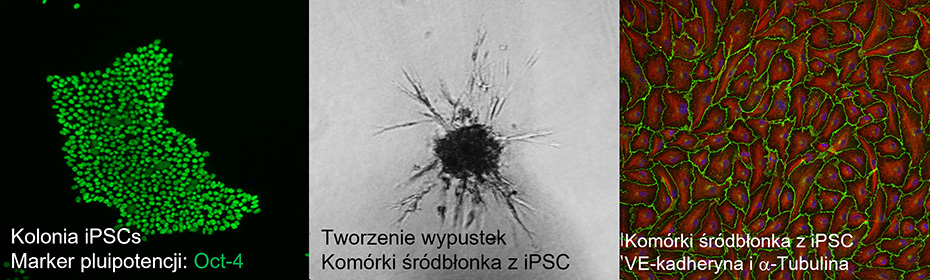
Obecnie w naszych badaniach przyglądamy się molekularnemu podłożu dysfunkcji komórek śródbłonka obserwowanej u pacjentów z monogenową cukrzycą typu MODY. Nasze badania opierają się na precyzyjnym modelowaniu tej choroby poprzez wykorzystanie zmodyfikowanych przez edycję genomu systemem CRISPR/Cas9 linii indukowanych pluripotencjalnych komórek macierzystych (iPSC).
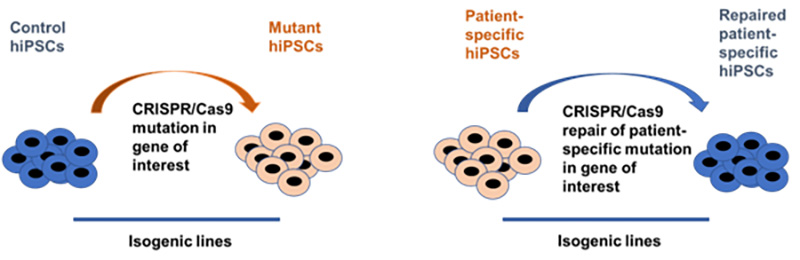
Poprzez wykorzystanie zaproponowanego przez nas systemu modelowania tej choroby, wykazaliśmy, że komórki z heterozygotyczną mutacją w genie HNF1A wykazują zwiększoną przepuszczalność w odpowiedzi na cytokinę prozapalną (Kachamakova-Trojanowska i wsp., 2019). Co ciekawe, efekt ten był spotęgowany w komórkach z mutacją bialleliczną. W związku z tym, staramy się obecnie przeanalizować tło molekularne obserwowanego wzrostu przepuszczalności i wykazać jego możliwy związek z mutacją w genie HNF1A.
- Pozyskiwanie iPSC z ludzkich komórek somatycznych
- Różnicowanie iPSC w kierunku komórek śródbłonka
- Techniki edycji genów z wykorzystaniem systemu CRISPR/Cas9
- Western-blot
- Barwienia immunofluorescencje
- Hodowle komórkowe w warunkach przepływu (system pomp ibidi)
- Przyżyciowe obrazowanie komórek (Nanolive)
- Badanie ekspresji genów (qPCR)
- Analizy z wykorzystaniem cytometrii przepływowej
- Techniki sortowania komórek

dr hab. Neli Kachamakova-Trojanowska
więcej o dr hab. Neli Kachamakova-Trojanowska
mgr Dawid Skoczek – doktorant
Pracownik naukowo-techniczny
Pani Dominika CzekalskaAlumni:
dr Damian Klóska
dr Marian Babincak
- Skoczek et al., Maturity Onset Diabetes of the Young-New Approaches for Disease Modelling, Int J Mol Sci. 2021. https://www.mdpi.com/1422-0067/22/14/7553
- Kachamakova-Trojanowska et al., HIF-1 stabilization exerts anticancer effects in breast cancer cells in vitro and in vivo. Biochem Pharmacol. 2020 https://www.sciencedirect.com/science/article/pii/S0006295220301507?via%3Dihub
- Białopiotrowicz et al., Serine Biosynthesis Pathway Supports MYC-miR-494-EZH2 Feed-Forward Circuit Necessary to Maintain Metabolic and Epigenetic Reprogramming of Burkitt Lymphoma Cells. Cancers (Basel). 2020 https://www.mdpi.com/2072-6694/12/3/580
- Szade et al., Heme oxygenase-1 deficiency triggers exhaustion of hematopoietic stem cells. EMBO Rep. 2020 https://www.embopress.org/doi/full/10.15252/embr.201947895
- Rozga et al., Novel engineered TRAIL-based chimeric protein strongly inhibits tumor growth and bypasses TRAIL resistance. Int J Cancer. 2019 https://onlinelibrary.wiley.com/doi/10.1002/ijc.32845
- Kachamakova-Trojanowska et al., Human iPSCs-Derived Endothelial Cells with Mutation in HNF1A as a Model of Maturity-Onset Diabetes of the Young, Cells. 2019 https://www.mdpi.com/2073-4409/8/11/1440
- Szade et al., Cobalt protoporphyrin IX increases endogenous G-CSF and mobilizes HSC and granulocytes to the blood. EMBO Mol Med. 2019 https://www.embopress.org/doi/full/10.15252/emmm.201809571
- Kachamakova-Trojanowska et al., Molecular profiling of regulatory T cells in pulmonary sarcoidosis. J Autoimmun. 2018 https://www.sciencedirect.com/science/article/pii/S0896841118302373?via%3Dihub
- Stepniewski et al., Heme oxygenase-1 affects generation and spontaneous cardiac differentiation of induced pluripotent stem cells. IUBMB Life. 2018 https://iubmb.onlinelibrary.wiley.com/doi/10.1002/iub.1711
- Stepniewski et al., Induced pluripotent stem cells as a model for diabetes investigation. Sci Rep. 2015 https://www.nature.com/articles/srep08597
• 2022- 2026 COST action CA21113 Genome Editing to Treat Humans Diseases (GenE-Humdi) – członek komitetu zarządzającego Dr hab. Neli Kachamakova-Trojanowska
• 2021-2025 Projekt Sonata-Bis: kierownik: Dr. Neli Kachamakova-Trojanowska: “Molekularne podłoże powikłań mikronaczyniowych u pacjentów cierpiących na cukrzycę HNF1A-MODY: indukowane pluripotencjalne komórki macierzyste jako narzędzie do modelowania choroby”
• 2017-2021 Projekt OPUS kierownik: by Dr. Neli Kachamakova-Trojanowska:“Edycja genu HNF1A w ludzkich indukowanych komórkach pluripotencjalnych za pomocą CRISPR/Cas9 w celu modelowania (dys)funkcji śródbłonka w cukrzycy typu MODY
dr hab. Neli Kachamakova-Trojanowska (neli.kachamakova-trojanowska@uj.edu.pl).
-
Poszukujemy osobę na stanowisku asystenta w ramach projektu Sonata-Bis. Zainteresowane osoby proszę o kontakt na email: neli.kachamakova-trojanowska@uj.edu.pl do 31.08.2023r.
- REKTOR Uniwersytetu Jagiellońskiego ogłasza konkurs na stanowisko ADIUNKTA (1227.1101.115.2024)

Lider | dr Monika Jakubowska
tel.: 12 664 6468; pokój 2/24

mgr Kinga Stopa

mgr Daria Krzysztofik
Finansowanie
2022-2024 NCN Project PRELUDIUM 20, awarded to Daria Krzysztofik: "Long-term exposure to high copper: does it affect the production of pancreatic digestive enzymes?"
2021-2022 POB BIOS Minigrant awarded to Dr. Monika Jakubowska
Title: "Copper misbalance and impaired exocrine pancreatic functions - ex vivo analyses of the Atp7b toxic milk mouse model"
2018-2020 FNP Project HOMING headed by Dr. Monika Jakubowska:“Targeting mechanisms of pancreatic cancer resistance against therapy: specific role of tumor microenvironment”
Wybrane publikacje
Kusiak et al., Activation of pancreatic stellate cells attenuates intracellular Ca2+ signals due to downregulation of TRPA1 and protects against cell death induced by alcohol metabolites, Cell death dis. 2022.
Ferdek et al., When healing turns into killing - the pathophysiology of pancreatic and hepatic fibrosis, J Physiol. 2022.
Du et al., A microRNA checkpoint for Ca2+ signaling and overload in acute pancreatitis, Mol Ther. 2022
Jakubowska et al., Electron paramagnetic resonance spectroscopy reveals alterations in the redox state of endogenous copper and iron complexes in photodynamic stress-induced ischemic mouse liver Redox Biol. 2020.
Stopa et al., Pancreatic Cancer and Its Microenvironment-Recent Advances and Current Controversies. Int J Mol Sci. 2020
Kusiak et al., Signaling in the Physiology and Pathophysiology of Pancreatic Stellate Cells - a Brief Review of Recent Advances, Front Physiol. 2020.
Jakubowska et al., ABT-199 (Venetoclax), a BH3-mimetic Bcl-2 inhibitor, does not cause Ca 2+ -signalling dysregulation or toxicity in pancreatic acinar cells. Br J Pharmacol 2019
Vervliet et al., BH4 domain peptides derived from Bcl-2/Bcl-XL as novel tools against acute pancreatitis, Cell Death Discov. 2018
Ferdek et al., BH3 mimetic-elicited Ca 2+ signals in pancreatic acinar cells are dependent on Bax and can be reduced by Ca 2+-like peptides, Cell Death Dis. 2017.

