
Dwa podstawowe obszary naszych badań to: ciała retikulum endoplazmatycznego ER jako chemicznego systemu obronnego u roślin oraz autofagia i kontrola jakości peroksysomów.
- Ciała retikulum endoplazmatycznego ER jako chemicznego systemu obronnego u roślin
- Autofagia i kontrola jakości peroksysomów
Ciała retikulum endoplazmatycznego ER jako chemicznego systemu obronnego u roślin
Rośliny bezszypułkowe nie mają możliwości wyboru środowiska, w którym rosną. Dlatego rośliny wykształciły wyrafinowane systemy obronne, aby dostosować się do zmian zachodzących w środowisku. Odkryliśmy ciałka ER i ich udział w tzw. systemie obronnym "mustard oil bomb" przeciwko zwierzęcymi roślinożercami. System ten działa poprzez akumulację β-glukozydazy (BGLU), która jest niezbędna do aktywacji obronnych glukozynolanów (rys. 1).
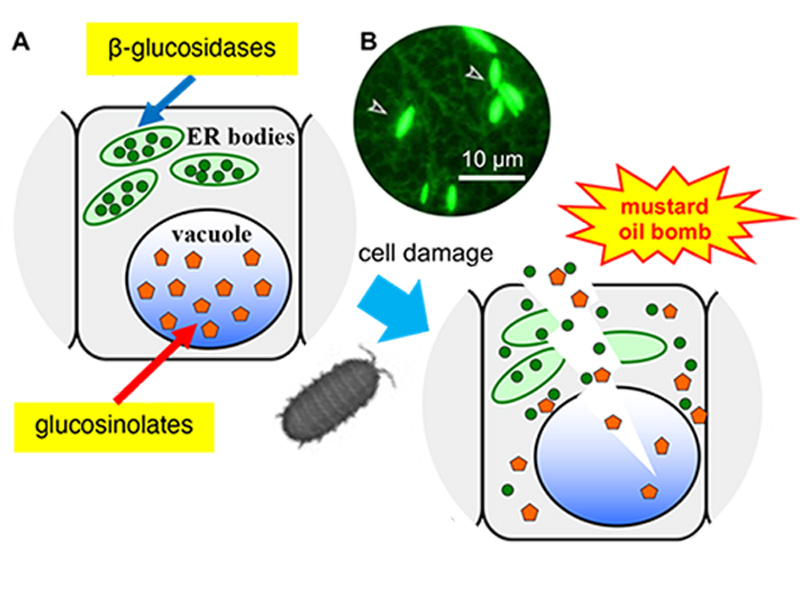
Rysunek 1. Arabidopsis thaliana posiada system obronny oparty na ciałkach ER.
(A) Ciała ER gromadzą β-glukozydazę (zielone koło), a wakuole gromadzą substraty, glukozynolany (pomarańczowy pięciokąt). Enzym i substrat wchodzą w kontakt i produkują toksyczne cząsteczki natychmiast po uszkodzeniach.
(B) Fluorescencyjny obraz roślin transgenicznych wyrażających ER-targeted GFP. Groty strzałek wskazują ciałka ER.
Ciała ER obserwowane są u roślin z rzędu Brassicales, w tym u rośliny modelowej Arabidopsis thaliana. U transgenicznej Arabidopsis wyrażającej białko zielonej fluorescencji (GFP) w retikulum endoplazmatycznym (ER), oprócz regularnej sieci ER obserwowano wrzecionowate ciałka ER (Rycina 1).
Dalsza analiza systemu obronnego ciałek ER ujawniła, że ciałka ER można podzielić na dwa typy. Ciała ER typu konstytutywnego (cER bodies) gromadzą się w siewkach i korzeniach, a ciała ER typu indukowalnego (iER bodies) są indukowane do akumulacji po zranieniu w liściach rozety poprzez działanie jasmonianu metylu (hormonu raniącego rośliny). Wydaje się, że rośliny Brassicaceae wyewoluowały różne systemy obronne, które zwiększają poziom obrony i umożliwiają elastyczne dostosowanie się do różnych poziomów zagrożenia.

dr Kenji Yamada
więcej o dr Kenji YamadaKenji Yamada (group leader, 2016-)
 Katarzyna Tarnawska-Glatt (postdoc, 2016-)
Katarzyna Tarnawska-Glatt (postdoc, 2016-)
 Shino Goto-Yamada (postdoc, project PI, 2016-)
Shino Goto-Yamada (postdoc, project PI, 2016-)
Kaichiro Endo (postdoc, project PI; 2018-)
Subhankar Bera (postdoc, 2021-)
Kritika Bhardwaj (postdoc, 2022-)
 Rituraj Batth (postdoc, 2022-)
Rituraj Batth (postdoc, 2022-)
 Natalia Stefanik (PhD student, 2016-)
Natalia Stefanik (PhD student, 2016-)
 Alwine Wilkens (PhD student, project PI, 2018-)
Alwine Wilkens (PhD student, project PI, 2018-)
Arpan Kumar Basak (PhD student, project PI, 2017-)
 Mohamadreza Mirzaei (PhD student, 2018-)
Mohamadreza Mirzaei (PhD student, 2018-)
Andisheh Masalehgou (PhD student, 2018-)
Elżbieta Borlik (PhD student, 2020-)
Karolina Małek (technician, 2018-)

Foto: Zespół Yamada Lab, Kwiecień 2022
Mohamadreza Mirzaei NCN PRELUDIUM 22 (2024-2025). Physiological relationship between vascular tissues and ER body-producing cells in Arabidopsis. UMO-2023/49/N/NZ3/02771
Kaichiro Endo NCN SONATA 17 (2022-2025). Exploring the novel vacuolar transporters of glucosinolates for supporting plant defense system against herbivores and pests in Arabidopsis thaliana. UMO-2021/43/D/NZ3/03222
Arpan Kumar Basak, NCN PRELUDIUM 20 (2022-2025). The other side of ER bodies: Revealing the function of ER body membrane proteins in Arabidopsis thaliana. UMO-2021/41/N/NZ3/04537.
Kenji Yamada, NCN OPUS 19 (2021-2025). Gene regulatory mechanism for the mustard oil bomb defence system of ER bodies in Brassicaceae. DEC-2020/37/B/NZ3/04176.
Alwine Wilkens, NCN PRELUDIUM 19 (2021-2023). On the shoulders of giants - How giant cells influence ER body formation. UMO-2020/37/N/NZ3/03591.
Shino Goto-Yamada, NCN SONATA 15 (2020-2023). Unveiling the molecular mechanism of microautophagy in plants. UMO-2019/35/D/NZ3/04500
Shino Goto-Yamada, NCN SONATA-BIS 9 (2020-2024). Molecular insight into the mechanism of peroxisome degradation via autophagy in land plants. UMO-2019/34/E/NZ3/00299
Katarzyna Sieńko, NCN MINIATURA 4 (2021). Odpowiedź transkrypcyjna na indukowany ciemnością proces starzenia się mutantów autofagii Arabidopsis thaliana. K/MNT/000179
Kenji Yamada, NCN OPUS19 (2017-2021). Plant defense system against pathogens and herbivores based on endoplasmic reticulum (ER) body. UMO-2016/23/B/NZ1/01847.
Shino Goto-Yamada, NCN POLONEZ2 (2017-2019). Analysis of quality control of peroxisomes depending on chaperon, protease and autophagy. UMO-2016/21/P/NZ9/01089
Kenji Yamada, NCN OPUS 23 (2023-2026). Molecular and genetic analysis of glucosinolate defence systems and their effect on plant root-microbe interactions. UMO-2022/45/B/NZ3/03700.
Jakub Bizan (technician, 2016-2021)
Toru Maeda (postdoc, 2018-2021)
Shayan Sarkar (postdoc, 2019-2021)
Olga Długosz-Grochowska (postdoc, 2018-2021)
Katarzyna Sieńko (postdoc, 2017-2021)

