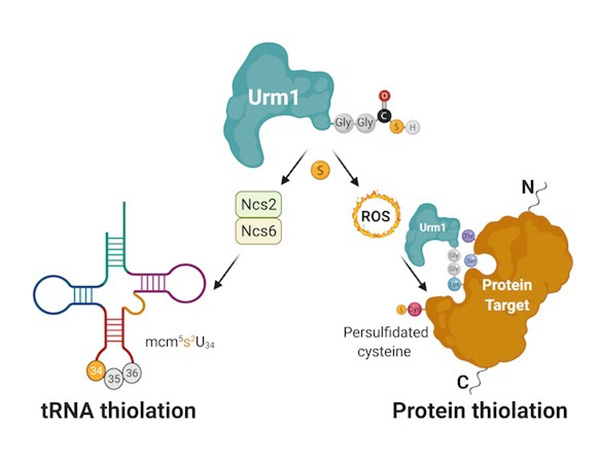
Persulfidacja jest unikalną potranslacyjną modyfikacją białek, która chroni nasze komórki i proteomy przed stresem oksydacyjnym i starzeniem się. Najnowsze prace z Małopolskiego Centrum Biotechnologii (MCB UJ) wykazały, że za tę niewielką modyfikację chemiczną odpowiada białko komórkowe, zwane modyfikatorem związanym z ubikwityną 1 (lub w skrócie Urm1).
Persulfidacja jest unikalną potranslacyjną modyfikacją białek, która chroni nasze komórki i proteomy przed stresem oksydacyjnym i starzeniem się. Najnowsze prace z Małopolskiego Centrum Biotechnologii (MCB UJ) wykazały, że ta niewielka modyfikacja chemiczna jest wprowadzana przez białko komórkowe, zwane modyfikatorem związanym z ubikwityną 1 (lub w skrócie Urm1). Ścieżka ta jest nie tylko aktywowana podczas stresu oksydacyjnego, ale co zaskakujące, jest również powiązana z innym rodzajem modyfikacji białek. Badanie dostarcza nowego molekularnego wglądu w nierozpoznany wcześniej mechanizm komórkowy i wskazuje, że terapie oparte na Urm1 mogą odegrać znaczącą rolę w opóźnianiu starzenia. Przełomowe wyniki zostały niedawno opublikowane w "The EMBO Journal" https://www.embopress.org/doi/10.15252/embj.2022111318.
Międzynarodowy zespół badaczy z Max Planck Research Group przy MCB Uniwersytetu Jagiellońskiego w Krakowie odkrył funkcję i mechanizm molekularny białka Urm1. To starożytne białko ubikwitynopodobne (UBL) i białko nośnikowe siarki (SCP) jest uznawane za przodka wszystkich eukariotycznych białek ubikwitynopodobnych. Prace zespołu badawczego w Krakowie kierowanego przez dr hab. Sebastiana Glatta (Glatt Lab) prowadzone były we współpracy z naukowcami z Universität Kassel w Niemczech i Universität Bern w Szwajcarii.
Opublikowane badanie pokazuje, że działanie Urm1 jest w stanie chronić inne enzymy w warunkach stresu oksydacyjnego. Zaobserwowano, że Urm1, wcześniej znany jedynie z przyłączania siarki do transferowego RNA (tRNA), jest również w stanie dostarczyć atomy siarki do specyficznych białek docelowych. Proces ten, zwany persulfidacją, jest ewolucyjnie zachowanym konstytutywnym mechanizmem obronnym przed stresem oksydacyjnym, który jest krytyczny podczas procesu starzenia się. Zespołowi udało się odtworzyć proces komórkowy w probówce i uzyskać pierwszą strukturę krystaliczną o wysokiej rozdzielczości białka docelowego poddanego urmylacji. Uzupełniające analizy biochemiczne potwierdzają bezpośredni transfer siarki z tiokarboksylowanego Urm1 na cysteiny modyfikowanych białek. W efekcie, naukowcy udowodnili, że persulfidacja cysteiny jest bezpośrednią konsekwencją przyłączenia Urm1, które jak wykazano, może zachodzić na resztach lizyny, seryny i treoniny.
Doktorant i główny autor, Keerthiraju E. Ravichandran, wyjaśnia "Kiedy laureat Nagrody Nobla Yoshinori Ohsumi odkrył i nazwał Urm1, stwierdził, że zrozumienie systemu Uba4-Urm1 zapewni głęboki molekularny wgląd w ewolucję wszystkich innych systemów koniugacji UBL. Dwie dekady później nasza praca pokazuje, że specyficzne przyłączanie UBL u eukariotów najprawdopodobniej wyewoluowało jako reakcja uboczna, która jest niezbędna do ochrony enzymów przez Urm1 w warunkach stresu oksydacyjnego." Dodaje również "Wyobrażam sobie, że system Uba4-Urm1 działa jak Wonder Woman lub Thor, którzy są uważani za odwiecznych cichych strażników i czujnych obrońców." Dr hab. Sebastian Glatt podsumowuje "Odkrycie, że tiokarboksylowany Urm1 może prowadzić ukierunkowaną persulfidację specyficznych cystein jest bezprecedensowe i nie zostało jeszcze opisane dla żadnego innego białka eukariotycznego. Przede wszystkim, nasza praca redefiniuje urmylację jako ewolucyjnie zachowany szlak sygnałowy, który jednocześnie dostarcza siarkę do RNA oraz do białek podatnych na utlenianie."
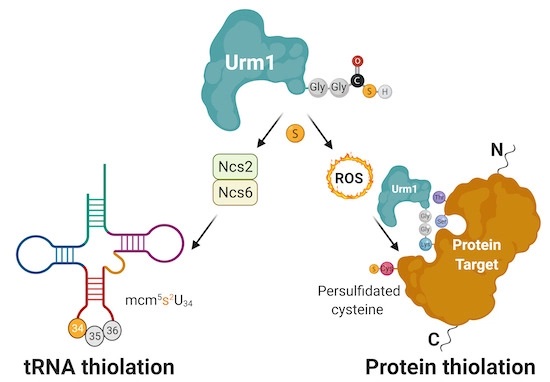
Rycina: Urm1 jest w stanie dostarczyć siarkę do niektórych tRNA i białek. Pośredniczona przez Urm1 tiolacja tRNA wymaga dodatkowych enzymów, ale persulfidacja cystein przez Urm1 jest bezpośrednio katalizowana przez podobną do UBL reakcję koniugacjiwyzwalaną przez stres oksydacyjny.
Ponadto, autorzy wykorzystują uzyskaną wiedzę do przeprojektowania znanych białek modelowych (np. białek fluorescencyjnych) do nowych zastosowań biotechnologicznych. W zawiązku z powyższym, główni autorzy złożyli również zgłoszenie patentowe dzięki wsparciu Centrum Transferu Technologii CITTRU Uniwersytetu Jagiellońskiego.
Praca była głównie wspierana przez grant First Team (POIR.04.04.00-00-1B00/16-00) z Fundacji na rzecz Nauki Polskiej oraz grant OPUS16 (2018/31/B/NZ1/03559) z Narodowego Centrum Nauki. Projekt ten otrzymał również finansowanie z Europejskiej Rady ds. Badań Naukowych (ERC) w ramach programu Unii Europejskiej Horyzont 2020 w zakresie badań i innowacji (umowa o dofinansowanie nr 101001394). Ponadto, MCB Structural Biology Core Facility (wspierane przez grant TEAM TECH CORE FACILITY POIR.04.04.00-00-43F6/17-00 Fundacji na rzecz Nauki Polskiej) zapewniło kluczowe wsparcie i niezbędne wyposażenie.

Artykuł został opublikowany w The EMBO Journal i jest dostępny w całości tutaj: