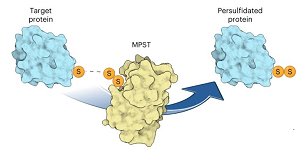
S-persulfidacja białek (P-SSH) jest uznawana za powszechną modyfikację potranslacyjną. Występuje ona w warunkach podstawowych i często obserwuje się jej wzrost w warunkach stresowych. Jednakże mechanizmy, dzięki którym białka są persulfidowane wewnątrz komórek, pozostają niejasne
Najnowsze badania Uniwersytetu w Heidelbergu, wykonane we współpracy z Grupą Badawczą Maxa Plancka w Małopolskim Centrum Biotechnologii (MCB) UJ, pokazują, jak ta niewielka modyfikacja chemiczna może być dokonana przez bezpośrednią reakcję enzymatyczną.
Prace zidentyfikowały sulfurtransferazę 3-merkaptopiranu (MPST) jako jeden z enzymów odgrywających kluczową rolę w generowaniu i utrzymywaniu nadsiarczków białkowych w ludzkich komórkach. Przełomowe wyniki zostały ostatnio opublikowane w czasopiśmie "Nature Chemical Biology".
Naukowcy z Grupy Badawczej Maxa Plancka w MCB UJ wsparli zespół dr. Tobiasa P. Dicka z Uniwersytetu w Heidelbergu swoją wiedzą i niedawno stworzonymi przez siebie narzędziami badawczymi. Badacze doświadczalnie potwierdzili hipotezy, że nadsiarczki białkowe mogą być generowane w wyniku procesu napędzanego enzymatycznie. Jest to zaskakujące, biorąc pod uwagę, jak enzymy ułatwiają i przyspieszają reakcje chemiczne. Wiadomo było, że MPST zadbiera siarkę z 3-merkaptopirynianu, produktu transaminacji cysteiny, generując nadsiarczek na cysteinie miejsca aktywnego MPST. Niemniej jednak, opublikowane badania pokazują teraz wyraźnie, że ten persulfidowany MPST następnie przenosi zewnętrzną siarkę do innych substratów, w tym tioli białkowych. Przede wszystkim, autorzy wykazali, że obniżenie poziomu MPST w ludzkich komórkach zmniejszyło również ogólny poziom persulfidacji białek. I odwrotnie, zwiększenie poziomów MPST podwyższyło komórkowe poziomy persulfidacji białek. Wyniki te świadczą o tym, że MPST ma kluczowe znaczenie dla persulfidacji białek w naszych komórkach.
Zespół z Uniwersytetu Jagiellońskiego kierowany przez dr hab. Sebastiana Glatta niedawno odkrył również, że jeden z dalszych celów oddziaływania MPST, mianowicie Urm1, może również przenosić siarkę ze swojego tiokarboksylowanego C-końca na cysteiny w niektórych białkach docelowych. Połączone wyniki badań pozwoliły zdefiniować nieznaną dotąd ścieżkę potranslacyjnej modyfikacji białek i ich funkcji enzymatycznych, które odgrywają bardzo istotną rolę w ochronie przed stresorami oksydacyjnymi oraz w procesie starzenia się.
Praca została wsparta finansowo przez Europejską Radę ds. Badań Naukowych (ERC) w ramach programu Unii Europejskiej Horyzont 2020 w zakresie badań i innowacji (umowa grantowa nr 101001394, PI Sebastian Glatt).
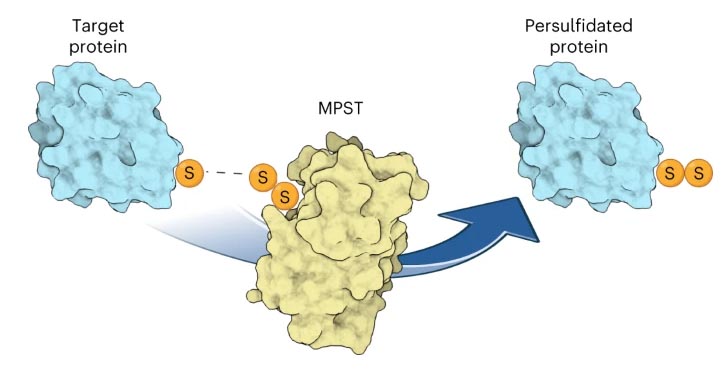
MPST jest w stanie dostarczyć siarkę do niektórych tRNA i białek. Pośredniczona przez Urm1 tiolacja tRNA wymaga dodatkowych enzymów, ale persulfidacja cystein przez Urm1 jest bezpośrednio katalizowana przez reakcję koniugacji uruchamianą przez stres oksydacyjny, przypominającą tę zachodzącą w białkach podobnych do ubikwityny.